
《重症肌无力自身抗体实验室诊断专家共识2022》首次对我国重症肌无力(MG)自身抗体实验室诊断方法学选择形成推荐意见,对推动MG抗体实验室诊断的规范化具有重要意义。MG是一类由自身抗体介导的神经-肌肉接头(NMJ)信号传递障碍的获得性自身免疫性疾病,自身抗体检测是国内外MG诊治指南推荐的关键辅助诊断指标。然而在不同国家和诊断中心,MG自身抗体的检测方法各异,检测方法学选择缺乏统一性的标准或共识,导致因方法学差异造成的诊断结果不一致常有发生,对患者和临床医生都产生困扰。因此,迫切需要对MG自身抗体检测方法学选择进行规范化。
MG自身抗体诊断方法学对临床上MG的定性诊断、临床试验和疗效追踪等具有实际影响。AChR和MuSK抗体是MG诊断的关键抗体指标,以AChR抗体为例,它们常用的诊断方法的特异度和敏感度存在显著的客观差异,相关方法学诊断效力研究结果如下:
因此,这种方法学引起的特异性和敏感性差异能够影响MG的定性诊断的临床符合度。与传统的ELISA和RIPA相比,CBA作为新兴的抗体诊断方法,在MG诊断、抗体分型和新药临床研究中的重要性和优势被越来越多的国内外MG权威专家认可。
现将《重症肌无力自身抗体实验室诊断专家共识2022》的MG诊断方法学推荐和影响RIPA、ELISA和CBA检测准确性的共性因素分析共性意见分享如下,供读者参考
一、MG自身抗体的实验室诊断推荐
1. 临床表现高度提示MG的患者,在条件允许的情况下建议将AChR抗体和MuSK抗体检测作为首选辅助检测手段(Ⅰ级推荐,1a级证据)。
推荐说明:本推荐意见参考了MG相关诊疗指南和专著。AChR抗体和MuSK抗体具有高度的MG疾病诊断特异度,是国内外指南普遍认可的MG诊断指标之一。结合患者临床特征,血清AChR或MuSK抗体是MG诊断和鉴别诊断的重要参考依据。
2. MG患者血清AChR抗体或MuSK抗体的定性分析,建议:(1)在条件允许的情况下优先考虑高敏感度的CBA法;(2)若首选方法为ELISA或RIPA,建议对检测结果为阴性的样本用CBA进一步验证,或结合临床表现和其他辅助诊断结果进行综合判定。AChR抗体或MuSK抗体的定量分析,建议用ELISA或RIPA进行抗体定量,用CBA进行抗体半定量。AChR抗体或MuSK抗体的定性分析可用于MG的诊断和鉴别诊断等,定量分析可用于监测MG患者的疾病进展或疗效评估等(Ⅰ级推荐,1b级证据)。
推荐说明:本推荐内容参考国内外AChR和MuSK抗体诊断指南和方法学研究进展。AChR和MuSK抗体的定性和定量分析策略兼顾了RIPA、ELISA和CBA的技术优势、时效性和临床可及性差异。需要注意的是,本推荐内容不对RIPA、ELISA和CBA的产品服务特征包括品牌、型号、同品种产品间的技术差异、检测操作流程和检测机构提供任何推荐,临床诊断时要根据检测结果的临床符合度自行选择具体的产品服务和检测机构。
3. LRP4抗体在MG中的致病性有待进一步研究,LRP4抗体也常出现于其他疾病如肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)。在MG自身抗体检测中,单纯LRP4抗体阳性应结合临床进行诊断,并注意与ALS的区分(Ⅰ级推荐,1b级证据)。
推荐说明:LRP4抗体对MG疾病诊断的特异度偏低,不同研究结果的检出率也存在较大差异。例如有研究结果显示2%~45%的AChR和MuSK抗体双阴性MG患者存在LRP4抗体。同时,9.8%~23.4%的ALS患者血清内也存在LRP4抗体。
4. 除AChR抗体和MuSK抗体外,MG其他相关自身抗体的实验室诊断方法学选择证据不足,目前尚无明确的方法学推荐建议。
5. 临床诊断为抗体阴性的MG患者,建议间隔6~12个月或症状进展后进行MG相关抗体复测(Ⅱ级推荐,2b级证据)。
推荐说明:研究结果表明部分RIPA检测结果为AChR和MuSK抗体双阴性的MG患者,间隔12个月后重新采样的血清中存在抗体转阳的情况。需要注意的是,ELISA和CBA检测缺乏相关的研究,尚无证据提示ELISA和CBA检测最初抗体为阴性的患者何时复查可能发现阳性,需要进一步的研究证据支持。
二、影响RIPA、ELISA和CBA 检测准确性的共性因素分析
在MG自身抗体实验室诊断中,一些常见的共性因素可能影响RIPA、ELISA和CBA检测结果的准确性,包括:
(1)各检测方法抗原的选择。抗原的含量、序列和空间构象等影响血清抗体的结合和检出率,因此检测时要考虑抗原抗体最适比例(等价带)、抗原的抗体识别区和抗原表位特征等。例如,CBA通过表达聚集性AChR抗原能够提高RIPA抗体阴性血清中AChR抗体的检出率。
(2)检测限(limit of detection)的限制。任何检测方法对血清中抗体含量的敏感度都是有限的,当血清中目标抗体的浓度接近或低于检测限时会存在无法准确判读的临界结果,造成假阴性或假阳性,这些情况需要结合临床或用其他辅助检测进行进一步诊断确认。
(3)室间检测条件的差异。如前所述各检测机构间的检测设备、试剂选择、检测环境、操作规范和人员专业化程度等因素差异会影响检测结果的准确性或一致性,需要合理的质量控制来控制。
(4)血清抗体的非特异交叉反应。临床上,待检测血清存在成分复杂和个体差异。血清中大量的非待测抗体具有与靶抗原或其他检测基质非特异交叉反应结合的可能性,当检测方法无法区分这种非特异性结合时(如ELISA、RIPA或单荧光CBA),会造成检测结果的假阳性。
一些措施被用于改善检测结果的特异度。例如,一些检测机构会采取适当提高检测方法(如ELISA、RIPA或CBA)的判读界值来提升检测结果的特异度,但相应地会降低抗体的检出率。此外,目前多数检测机构采用含内参的双荧光CBA替代单荧光CBA,从而实现对靶抗原表达细胞和非表达细胞的区分,在检测时可以分辨血清成分的非特异结合信号,从而提高检测结果的特异度(图1)。
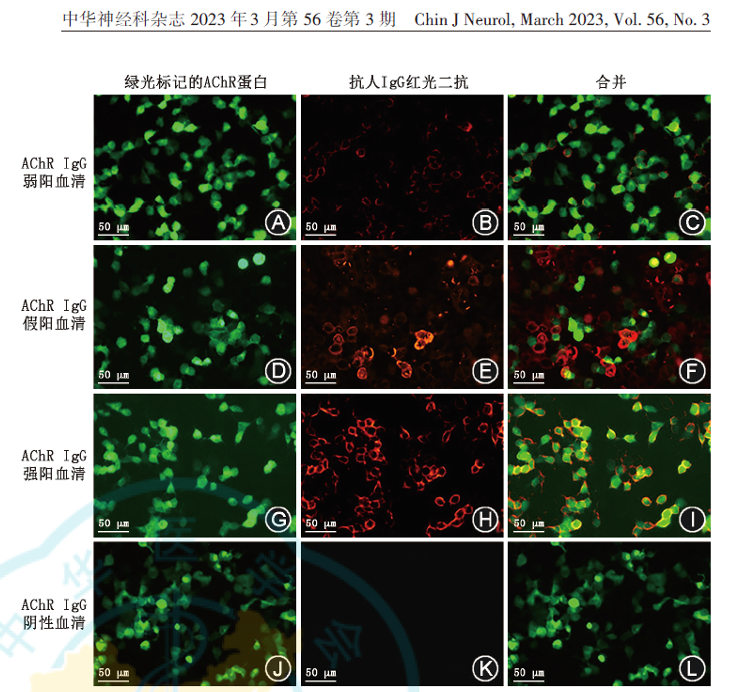
图1 重症肌无力乙酰胆碱受体(AChR)抗体细胞免疫荧光法(CBA)检测的双荧光判读示意图
如图所示,体外培养的293细胞转染人完整的AChR和突触受体关联蛋白(rapsyn),并采用绿色荧光蛋白(GFP)作为AChR抗原阳性细胞的标记。当AChR抗原阳性细胞与待检血清进行孵育后,血清内的AChR IgG抗体特异结合到293细胞表达的AChR抗原上。再通过孵育荧光或辣根标记抗人IgG二抗,直接通过荧光显微镜或进一步利用酪胺信号放大技术(TSA)把结合到细胞上的AChR抗体转化为红色荧光信号,实现对血清内AChR IgG的定性和半定量判读。血清AChR抗体弱阳性[放射免疫沉淀法(RIPA)阴性]且临床症状符合MG患者的代表性图片(A-C)。红色信号与AChR-GFP绿色信号完全重合,提示血清内存在和AChR抗原特异性结合的抗体。血清AChR抗体假阳性代表性图片(D-F)。红色信号与AChR-GFP绿色信号不完全重合,提示患者血清内没有和AChR抗原特异性结合的抗体,红色信号为非特异性信号。血清AChR抗体阳性对照(G-I)。血清AChR抗体阴性对照(J-L) 标尺:50 μm
临床上存在各检测方法检测AChR和MuSK抗体均为阴性的MG患者。AChR和MuSK抗体阴性的主要原因包括:
需要注意的是,MG的临床诊断不能过度依赖自身抗体的检测结果。一方面,部分抗体阴性患者的临床表现符合MG疾病特征,无法排除患MG的可能性。另一方面,AChR抗体阳性并不一定是MG患者。一些研究表明,少数非MG人群(1.44%)以及其他自身免疫病患者(如6.25%的视神经脊髓炎患者)的血清中存在AChR抗体。此外,受抗体检测机构质控和临界值判读标准差异的影响,任何抗体检测结果都不是绝对准确的,存在假阳性和假阴性的可能性。因此,MG临床诊断除了参考自身抗体指标,一定要结合患者的临床表现和其他非抗体诊断指标和随访等进行综合判定。
天海新域专注于自身免疫病的诊断服务和LDT产品研发,致力于为神经免疫病患者和临床医生提供优质的诊断服务。目前,天海新域是国内最大的MG自身抗体CBA诊断中心,年诊断量达1.5万例以上。同时,自研LDT产品已服务于全国多家医院诊断实验室和第三方诊断平台。
参考文献: