重症肌无力(Myasthenia Gravis,MG)是一种慢性自身免疫性疾病,其核心特征是骨骼肌的进行性无力,严重时可导致呼吸衰竭甚至瘫痪,严重影响患者的生活质量。该疾病的根本原因在于患者体内产生的自身抗体错误地攻击了神经肌肉接头处的乙酰胆碱受体(AChR),从而干扰了神经信号向肌肉的正常传递,导致肌肉无法正常收缩。
尽管目前已有多类治疗方案可用于MG,包括旨在增加神经递质乙酰胆碱(ACh)可用性的药物、广谱免疫抑制剂,以及近年来新出现的补体抑制剂等,但临床实践中观察到患者对这些疗法的反应差异显著。例如,约40%的患者对补体抑制剂反应不佳,甚至有部分患者在治疗过程中病情反而恶化。这种临床疗效的显著差异,提示致病机制存在异质性。传统诊断方法通常仅限于检测血清中的AChR特异性抗体,却往往未能深入揭示驱动个体患者MG病情的具体分子机制。这种诊断上的局限性,使得当前依赖于广谱免疫抑制或单一靶点(如补体)的治疗策略,对于许多患者而言可能并非最优选择,从而凸显了深入理解MG分子基础的迫切需求。
近期,一项发表在Cell杂志上的开创性研究,通过高分辨率结构生物学和功能分析,为理解MG的复杂免疫病理学机制提供了关键见解。
长期以来,由于AChR复杂的亚基组成以及在体外高效表达和纯化的技术挑战,其完整的三维结构一直难以获得。这项研究的关键突破在于,研究团队通过构建稳定转染细胞系,成功实现了人类成人AChR的高效重组表达和纯化。在此基础上,研究人员首次利用先进的冷冻电镜(cryo-EM)技术,成功解析了人肌肉AChR在apo(未结合配体)静息态和ACh结合脱敏态的cryo-EM图谱,其精细度达到原子级别,使得研究人员能够从头构建受体模型,甚至清晰地识别出ACh分子、聚糖和脂质等关键细节。这项技术上的突破,直接解决了困扰领域多年的核心障碍,将MG研究从依赖间接推断和动物模型,提升到能够直接观察人类受体-抗体相互作用的层面,具有里程碑式的意义。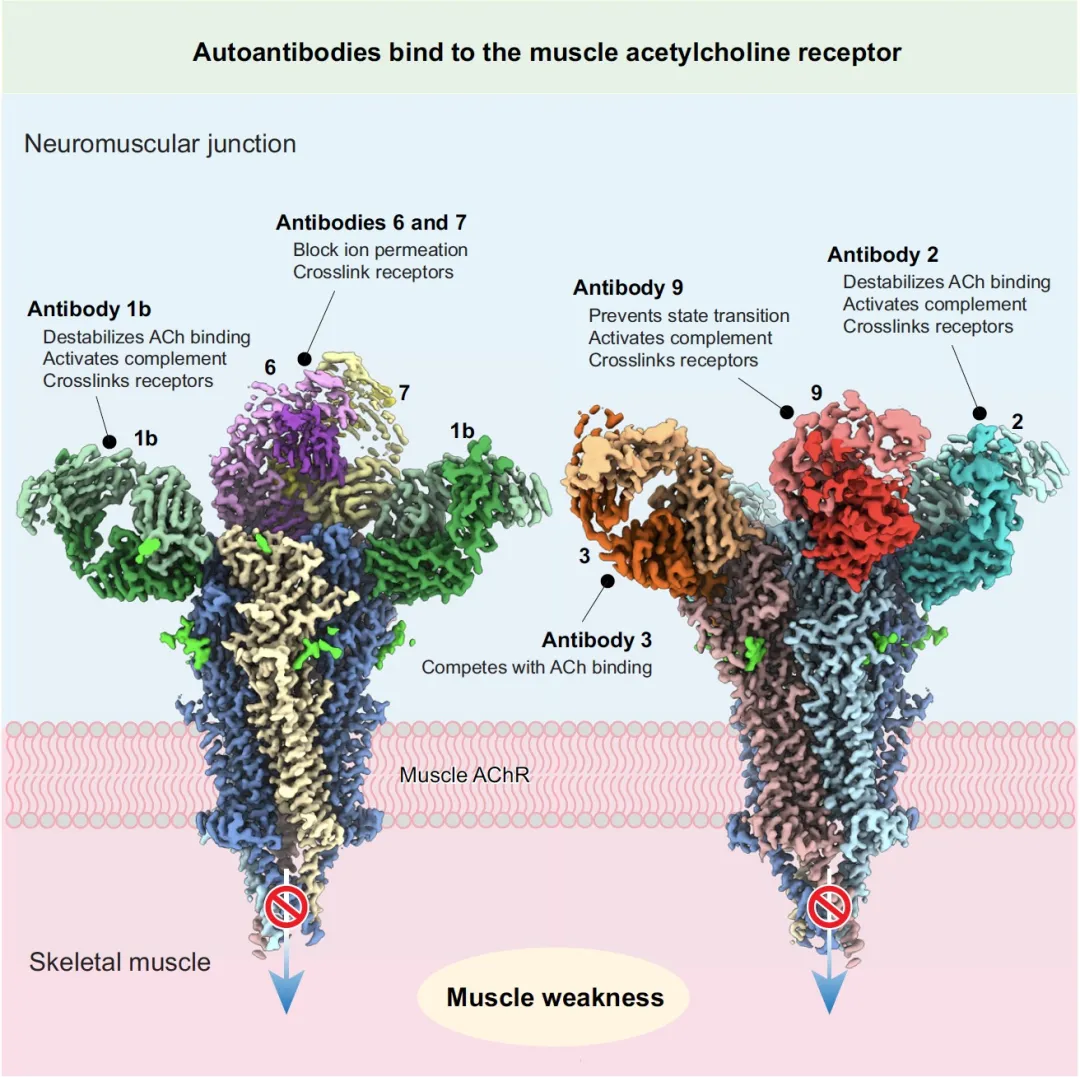
图1 自身抗体与肌肉乙酰胆碱受体结合示意图
人类肌肉AChR由五个亚基组成,包括两个α1亚基、一个β1亚基、一个δ亚基和一个ε亚基,它们以异聚五聚体的形式围绕着一个中央离子通道轴排列。每个亚基都包含一个胞外域(ECD)、一个形成离子通道孔的跨膜域(TMD),以及一个包含支架蛋白结合位点和能调节离子传导残基的胞内域(ICD)。通过建立原子级别的正常功能模型,研究人员为后续分析自身抗体如何致病提供了精确的基准。这使得他们能够识别抗体如何不只是简单地“阻断”ACh结合,而是通过干扰这些特定的、动态的构象转变(例如,阻止C环闭合、阻碍ECD运动)来破坏受体功能。这种理解将MG的病理学从简单的结合干扰提升到复杂的变构调节层面,是疾病机制理解上的一个重大概念性进展。
这项研究通过解析六种来自不同MG患者的单克隆抗体(Fab片段)与AChR的复合体结构,揭示了抗体结合异质性。这些Fab片段在抗原表位识别、结合化学计量、亚基特异性以及相对于受体的空间方向上均表现出显著差异。尽管所有五个AChR亚基都参与了抗体结合,但α1亚基承载了更多的表位决定簇,这与之前的发现一致。
传统观点认为,α1亚基上的“主要免疫原区”(MIR)是大多数MG自身抗体的主要靶点。这一推断主要基于间接的竞争性结合实验,即通过抑制自身抗体与结合α1 MIR的鼠抗体mAb35的结合来推断。然而,这项研究令人惊讶地发现,所研究的六种致病性单克隆抗体中,没有一种直接结合α1 MIR。尽管如此,它们中的大多数仍然能够有效竞争原型MIR抗体mAb35的结合。这表明,这种竞争是由于空间位阻或变构拮抗作用来干扰mAb35的结合,而非直接竞争同一表位。这一发现从根本上挑战了MG诊断和治疗中长期存在的“主要免疫原区”范式,强调了靶向α1 MIR以外表位的重要性。这进一步意味着,仅仅依赖α1 MIR反应性的诊断方法可能会漏诊重要的致病性抗体,而仅针对α1 MIR的治疗策略其疗效将受限。这一发现极大地拓宽了药物开发的靶点范围,并要求未来诊断方法必须更加全面,以识别更广泛的致病性抗体表位。
本研究通过结合结构分析和电生理学功能测试,提出并详细阐明了自身抗体直接干扰AChR通道活性的至少四种全新机制。这扩展了对“阻断ACh结合”这一传统概念的理解,将其提升为更广义的“干扰通道活性”。传统观点认为,自身抗体直接抑制AChR功能被认为是罕见的,或主要通过简单地阻断ACh结合。然而,这项研究明确定义了这些多样化、精细的直接抑制机制,揭示了自身免疫病理学的复杂性和精巧性。这些发现表明,即使是那些传统上不被归类为“阻断型”(例如,通过α-银环蛇毒素结合试验)的抗体,也可能通过这些新发现的机制表现出高度致病性。这要求对现有诊断方法进行重新评估,并推动开发针对这些多样化抑制模式的疗法,而不仅仅是预防ACh结合。
表1 重症肌无力自身抗体直接抑制AChR通道的机制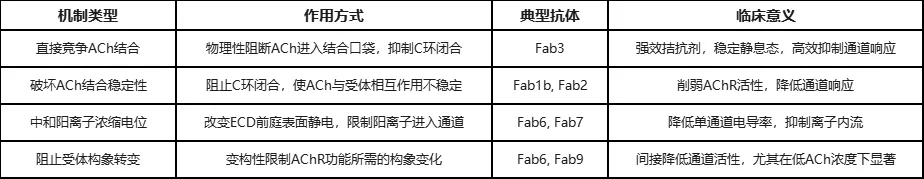
这项研究的结构分析揭示,抗体与AChR结合时的空间角度和精确方向对抗体介导的补体激活至关重要。在经典的补体途径中,IgG1抗体需要组装成一个六边形的Fc平台,才能有效招募C1q并激活信号。在这项研究中,mAb1b、mAb2和mAb9等抗体与受体中心轴的结合角度在60°到70°之间,这种角度使得IgG的Fc区域能够投射到适合与其他Fc分子形成六聚体平台的位置,并呈现结合C1q所需的残基。这与这些抗体能够有效激活补体的实验结果高度一致。这项发现建立了抗体在受体上的“空间结合角度“和其“激活补体能力”之间的直接因果关系,揭示了MG主要致病途径之一的结构决定因素。相比之下,mAb6和mAb7的结合角度较小(低于30°),这可能阻碍IgG1六聚体的形成,从而导致C1q招募效率低下。值得注意的是,mAb3虽然结合角度看似合适,但其轻链和重链的方向发生了旋转,导致Fc区域定位在一个不利于C1q招募的角度。然而,由于mAb3本身是IgG3亚型,其延伸的铰链区可能在体内补偿了补体活性。这表明,不仅是结合角度,抗体链的精确方向也对补体激活能力至关重要。
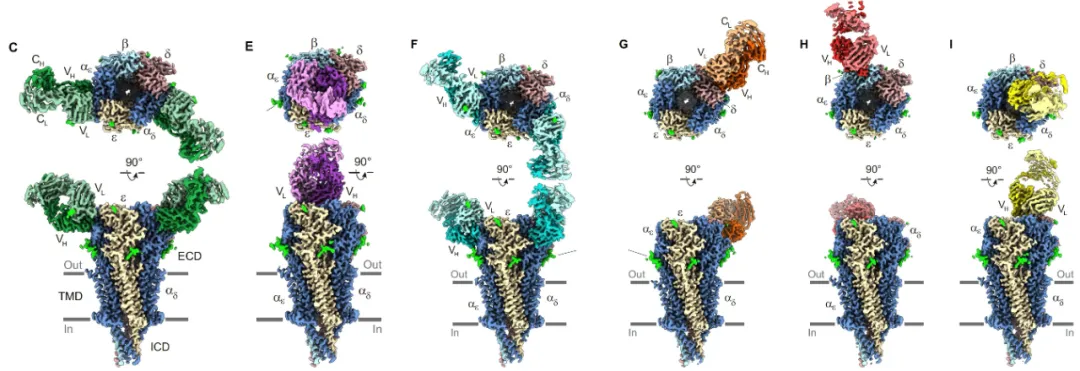
MG发病机制中一个长期存在的机制是抗体介导的受体交联和内化,导致AChR数量减少。这项研究的结构模型表明,单个双价IgG1抗体的两个Fab臂的几何和空间限制,使它们无法结合同一受体内的两个位点。然而,抗体的结合方向使得它们能够结合相邻的AChR并交联至少两个受体。这得益于神经肌肉接头处由骨架蛋白rapsyn稳定形成的AChR具有较高的密度。
进一步推测,IgG1的结构限制可能需要细胞膜发生变形才能实现有效的受体交联。这种推断与之前对MIR定义抗体mAb35的研究结论相似,表明Fab结合角度可能与膜曲率有关,一些抗体可能仅需轻微的膜变形,而另一些则可能诱导更大的膜曲率,从而促进交联和内化。这项研究表明,抗体介导的内化可能并非简单的被动聚集过程,而可能涉及抗体诱导的细胞膜主动物理变化。这为MG病理学研究开辟了新的方向,它暗示了抗体与膜曲率的“匹配度”也可能是致病性的一个决定因素。
这项研究提供的详细抗原表位图谱和多样化致病机制的阐明,为开发基于机制的精准诊断工具提供了全新框架。目前MG诊断主要依赖检测AChR抗体,但往往忽略了驱动个体患者病情的具体分子机制。未来的诊断工具将不再仅仅是简单地判断AChR抗体是否阳性,而是能够识别患者体内哪种特定的致病机制占据主导地位(例如,抗体主要通过破坏ACh结合稳定性,还是高效激活补体)。这种精细的诊断能力将是实现个性化治疗的关键一步。这一丰富的机制细节为设计下一代诊断方法提供了精确的依据。未来的诊断可以识别患者体内主导的致病途径,这是实现个性化医疗的直接途径。
这项研究为开发个性化治疗策略奠定了坚实基础,旨在更精准地预测和治疗疾病复发。鉴于抗体结合位点的显著异质性,仅仅靶向α1 MIR的治疗方法将限制疗效。未来的治疗可能需要根据患者体内抗体的主要致病机制进行定制。例如,对于主要通过中和阳离子浓缩电位来致病的抗体,可以开发靶向该机制的小分子药物;对于主要通过阻止构象转变的抗体,则可能需要不同的干预策略。这标志着MG治疗将从广谱免疫抑制向靶向性、精准性方向发展。
参考文献:Li H, Pham MC, Teng J, et al. Autoimmune mechanisms elucidated through muscle acetylcholine receptor structures. Cell. 2025 May 1;188(9):2390.