
自身免疫性脑炎(AIE)是一种由自身免疫机制介导的脑炎性疾病,以亚急性起病的神经精神症状为主要特征,其发病率为0.2-0.8/10万人年,与感染性脑炎相当。本指南采用改良的RAND方法制定,结合了自身免疫性神经病学、神经精神病学和传染病学专家的意见,为一线临床医生提供了实用的诊疗方案。
AIE可发生于各年龄段,但存在抗体特异性的年龄偏好:抗NMDAR脑炎多见于儿童和年轻女性,而抗LGI1脑炎以老年男性为主。个人或家族自身免疫病史是潜在危险因素,风险因素方面,除自身或家族自身免疫病史外,既往感染史是明确诱因,尤其是单纯疱疹脑炎(HSE)后,约20%患者可能继发AIE,机制可能与分子模拟或免疫交叉反应有关。免疫检查点抑制剂(如PD-1/PD-L1抑制剂)的应用显著增加AIE风险,这类药物通过解除免疫抑制导致自身反应性T细胞活化,引发包括脑炎在内的多种免疫相关不良反应。
(一)核心症状与病程特点
AIE的典型病程为亚急性起病(症状在3个月内进展),但LGI1、CASPR2等抗体相关脑炎可呈隐匿起病,易被误诊为神经退行性疾病。前驱症状多样,感染相关症状(发热、咽痛)见于约40%患者,非特异性症状(头痛、睡眠障碍、体重下降)更为常见,可持续数天至数周后出现核心神经精神症状。
核心症状群包括三类:①精神状态改变(注意力不集中、定向障碍、意识水平波动);②认知功能障碍(尤以工作记忆受损突出);③癫痫发作与精神症状(幻觉、妄想、躁动)。不同抗体亚型具有特征性表现:LGI1脑炎常伴面臂肌张力障碍性癫痫(FBDS)及低钠血症;NMDAR脑炎可见口面部不自主运动、自主神经功能紊乱;CASPR2抗体相关病例可能出现Morvan综合征( neuromyotonia 伴失眠)。
(二)误诊风险与鉴别要点
临床误诊率高达27%,主要原因包括:①过度依赖血清抗体阳性结果,忽视临床表型匹配;②将非特异性认知-精神症状简单归为功能性疾病;③对抗体阴性AIE认识不足。需重点鉴别的疾病包括:感染性脑炎(HSV、EBV等)、代谢性脑病(甲状腺功能异常、维生素B12缺乏)、中枢神经系统淋巴瘤及神经退行性疾病(如路易体痴呆)。
对于孤立性精神症状患者,需警惕“红 flags”:症状快速进展、伴随神经系统体征(如癫痫、运动障碍)、抗精神病药物疗效差或出现恶性综合征,这些情况提示需进一步行脑脊液及神经影像学检查。
确定AIE需具备神经特异性抗体阳性,或符合边缘性脑炎/急性播散性脑脊髓炎(ADEM)/Bickerstaff脑炎的特定标准。对于仅表现为精神症状的患者需谨慎,NMDAR抗体在精神分裂症患者及健康人中也可能检出,但其脑脊液阳性更具特异性。
采用Graus等2016年提出的分层诊断标准,分为可能、很可能和确定三级,核心在于结合临床表型、辅助检查及抗体检测结果综合判断。
(一)可能AIE诊断标准
需同时满足:
1. 亚急性起病的工作记忆缺陷、精神状态改变或精神症状;
2. 至少一项支持证据:①新发局灶神经体征;②无法解释的癫痫发作;③脑脊液白细胞>5/mm³;④MRI提示脑炎(如内侧颞叶T2/FLAIR高信号);
3. 合理排除感染、肿瘤、代谢等其他病因。
(二)确定AIE诊断标准
在可能AIE基础上,需具备以下任一条件:①脑脊液或血清检出神经特异性抗体(如NMDAR、LGI1等);②符合边缘性脑炎、ADEM或Bickerstaff脑炎的特异性标准且抗体阴性但有典型炎症证据(如脑脊液寡克隆带、MRI强化)。
值得注意的是,抗体检测结果需结合临床解读。例如,血清NMDAR抗体在健康人群中检出率约0.1%,而脑脊液阳性则特异性显著提高(>95%);LGI1抗体在血清中更易检出,脑脊液阳性率较低。
(一)实验室检查
1. 脑脊液与血清检测:
脑脊液检查对AIE诊断至关重要,典型表现包括轻中度淋巴细胞增多、脑脊液特异性寡克隆带、IgG指数升高和/或蛋白升高;约30%患者脑脊液可正常,检测寡克隆带能显著提高敏感性;血清检查需排除感染、代谢和系统性自身免疫性脑病,如65%的LGI1抗体脑炎患者存在低钠血症。
2. 神经抗体检测:
推荐采用综合性panel检测而非序贯单项检测,以提高敏感性;血清对LGI1和CASPR2抗体敏感性更高,而脑脊液对NMDAR和胶质纤维酸性蛋白(GFAP)抗体更敏感,因此建议同时检测血清和脑脊液;组织间接免疫荧光/免疫组织化学(TIIF/IHC)是优化检测的标准方法;甲状腺抗体和电压门控钾通道(VGKC)抗体检测价值有限,不建议常规开展。
(二)影像学检查
1. MRI:所有疑似AIE患者均需行脑MRI(含钆增强),边缘性脑炎典型表现为双侧内侧颞叶T2/FLAIR高信号;约25-50%患者早期MRI可正常,诊断不明时需复查。
2. FDG-PET:敏感性(87%)高于MRI(25-50%),可显示早期代谢变化,但特异性未知,不应单独作为诊断依据。
(三)脑电图(EEG)
可显示局灶性改变(即使MRI正常),极端δ刷多见于NMDAR抗体脑炎(30%),但非特异。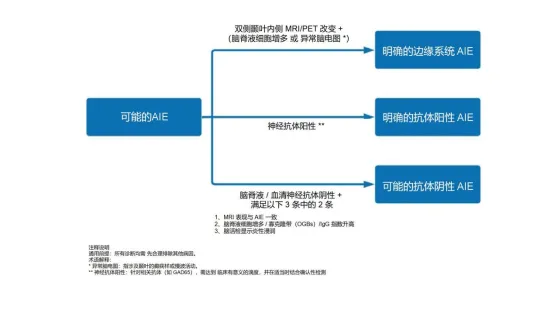 图1:自身免疫性脑炎(AIE)诊断流程
图1:自身免疫性脑炎(AIE)诊断流程
(一)一线治疗
1. 严重AIE:推荐大剂量激素(1g IV甲泼尼龙每日×5天)联合静脉免疫球蛋白(IVIg,2g/kg over 2-5天)或血浆置换(PLEX,10天内5次交换);
2. 轻中度AIE:可考虑激素单药治疗,但建议咨询自身免疫性神经病学专家;
3. 激素治疗后建议逐渐减量,可采用0.5-1mg/kg/日泼尼松口服,4-12周减量,或脉冲式给药方案。
(二)治疗失败与二线治疗
1. 治疗失败定义:严重AIE在一线治疗后5-10天无改善或恶化,轻中度AIE在2-4周无改善;
2. 二线治疗选择:
细胞表面抗体阳性或抗体阴性患者:优先选用利妥昔单抗(1g×2次,间隔2周);胞内抗体阳性患者:优先选用环磷酰胺(每月IV,持续3-6个月);若存在肿瘤,需同时进行抗肿瘤治疗。
(三)其他治疗
难治性病例可考虑三线治疗(如托珠单抗、硼替佐米),需专家会诊。
AIE与肿瘤的关联因抗体类型而异,故需个体化筛查策略:
1. 高风险抗体(如Hu、Yo、CRMP5):肿瘤发生率>70%,推荐三步筛查:①全身CT;②性别特异性检查(如女性盆腔MRI、男性睾丸超声);③全身FDG-PET。
2. 中风险抗体(如NMDAR、AMPAR):肿瘤发生率30-70%,重点筛查卵巢(女性)、肺部及胸腺。
3. 低风险抗体(如LGI1、GAD65):肿瘤发生率<30%,基础筛查阴性后无需常规随访。
随访策略:中高风险患者需每3-6个月复查,持续至少2年,因肿瘤多在AIE诊断后1年内检出。抗体阴性但表现为边缘性脑炎或对治疗反应差者,也需延长监测。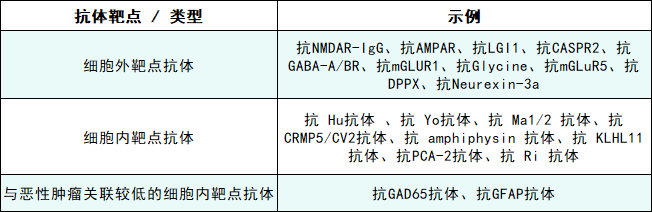
表:与脑炎相关的抗神经抗体
1. 癫痫:推荐免疫抑制联合抗癫痫药物(ASMs)治疗,钠通道阻滞剂对LGI1相关癫痫可能更有效;
2. 神经精神症状:非典型抗精神病药优先选用,苯二氮䓬类可用于躁动和紧张症,电抽搐治疗对难治性紧张症可能有效;
3. 长期认知障碍:需康复治疗和家庭支持,注意力、记忆和执行功能损害常见。
1. 复发:定义为初始改善后明确恶化,伴MRI或CSF炎症证据,治疗同初始发作;
2. 长期免疫抑制:首次发作不常规推荐,严重或复发病例可考虑1-2年治疗;
3. 免疫抑制风险:
筛查潜伏感染(VZV、HIV、乙肝/丙肝、结核);接种灭活疫苗,避免活疫苗;20mg泼尼松等效剂量持续2周以上需预防肺孢子菌肺炎(PJP)。
本指南强调AIE诊疗的时效性与个体化,核心原则包括:①早期识别典型临床表型,避免误诊;②结合脑脊液、影像学及抗体检测综合诊断;③根据病情严重度与抗体类型分层治疗;④重视肿瘤筛查与长期并发症管理。
参考文献:
【1】Hahn C, Budhram A, Alikhani K, et al. Canadian Consensus Guidelines for the Diagnosis and Treatment of Autoimmune Encephalitis in Adults. Can J Neurol Sci. 2024 Feb 5:1-21.